Geschichte der Antikoagulation
Das erste orale Antikoagulanz wurde durch Zufall 1922 in North Dacota entdeckt: Rinder entwickelten nach dem Verzehr von Süßklee schwere Blutungen. Ursächlich für die Süßkleekrankheit war Dicumarol, welches 1938 erstmals beim Menschen eingesetzt wurde. Nachteile der aus der Muttersubstanz abgeleiteten Medikamente sind u.a. die interindividuell erhebliche Varianz der Wirkung, die lange Halbwertzeit und zahlreiche Interaktionen. Die in der Anfangszeit häufige Marcumarnekrose (s. Abb. bei Wikipedia >>) ist heute zum Glück selten geworden.
Heparin wurde erstmals 1916 von dem Medizinstudenten Jay McLean aus Hundeleber isolierte (daher der Name Heparin, initial hieß es Cephalin), welches seit 1936 beim Menschen angewendet wird [McLean J: The thromboplastic action of cephalin. Am J Physiol 1916; 41:250-257] PDF >>. 1947 definierte die WHO den 1. Internationalen Standard für Heparin, 1967 wurde der Wirkstoff erstmalig standardisiert eingesetzt.
Erst 1973 konnte der Mechanismus aufgeklärt werden: Das körpereigene Glykoprotein Antithrombin (früher auch AT-III) hemmt physiologisch u.a. die Serinproteasen Thrombin oder Faktor Xa. Diese Hemmung der Gerinnungsfaktoren läuft unter physiologischen Bedingungen nur sehr langsam ab (»Progressivinhibitor«). Appliziertes Heparin bildet zusammen mit AT einen Komplex. Heparin bewirkt in diesem Komplex eine Konformitätsänderung am aktiven Zentrum von AT. Dieser Heparin-AT Komplex hat eine 10.000 fache höhere Reaktionsgeschwindigkeit bei der Hemmung der o.g. Gerinnungsfaktoren als z.B. Thrombin oder Faktor Xa. (»Sofortinhibitor«).
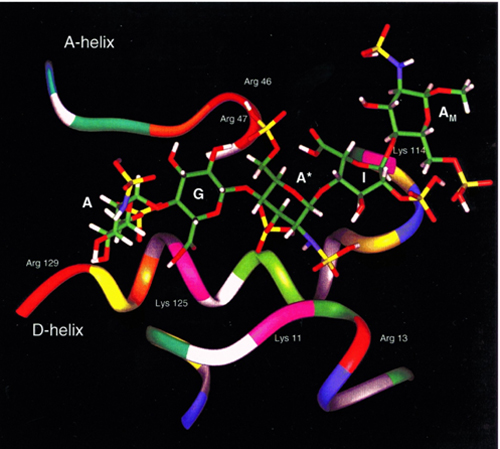
Abb. 9.0: Conformation of the heparin pentasaccharide in complex with AT
[Biochemical Journal Biochem. J. (2001) 359, 265-272]
Heparin wird aus diesem Komplex auch wieder freigesetzt und kann dann mit weiteren AT-Molekülen reagieren (Katalysatorwirkung). Wesentlich für die antikoagulierende Wirksamkeit des Heparinmoleküls ist eine Pentasaccharidsequenz = High-affinity-Region. [Rosenberg RD, Damus PS. J Biol Chem. 1973 Sep 25;248(18):6490-505)].
Definition: 1.000 IE Heparin vermögen 1 l Schafs- oder Rinderblut bei 37 °C eine Stunde lang ungerinnbar zu machen.
Die Substanz wies zahlreiche Nachteile auf: beispielhaft seien hier kurze Halbwertzeit, die geringe Bioverfügbarkeit bei s.c. Injektion und die chemisch »unreine« Substanz genannt.
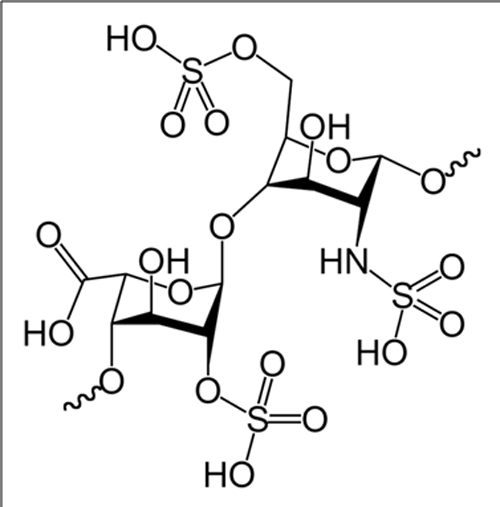
Abb. 9.1: Heparine bestehen aus jeweils abwechselnden Folgen von D-Glucosamin und einer Uronsäure (D-Glucuronsäure oder L-Iduronsäure). Mit einer Kettenlänge von fünf Monosacchariden (drei D-Glucosamine und zwei Uronsäuren) sind sie bereits gerinnungshemmend.

Abb. 9.2: Dr. Jay McLean
Noch heute wird die Rohsubstanz aus Schweinedarm isoliert. Dieses Roh-Heparin kommt heute fast ausschließlich aus China.



Abb.16-4: Heparin-Herstellung aus Schweinedarm in China
[Artikel: making heparin is a dirty job] | [weitere Photos >> ]
Nebenwirkungen wie das HIT Syndrom sind auch heute gefürchtet. Dies hat zur Entwicklung weiterer Gerinnungshemmer geführt.
So wurde mit dem Thrombininhibitor Lepirudin (Refludan®) 1997 das erste Arzneimittel zur Behandlung von HIT-Patienten in der Europäischen Union zugelassen (Marktrücknahme zum 01.04.2012). In Anlehnung an Hirudin wurde das Peptidanalogon Bivalirudin (Angiox®) entwickelt, welches zusammen mit ASS bei der PTCA eingesetzt wird.
1983 konnte Jean Choay die für die AT-Bindung verantwortliche Pentasaccharid-Sequenz synthetisieren. Diese fraktionierten oder »Low-dose« Heparine werden seit 1986 eingesetzt. 2002 wurde mit Fondaparinux (Arixtra®) das erste synthetisch hergestellte sulfatierte Pentasaccharid zugelassen, das spezifisch mit hoher Affinität an Antithrombin III bindet. Im Gegensatz zu Heparin hemmt es ausschließlich FXa und besitzt mit 700 I.U./mg eine vielfach höhere spezifische Aktivität.
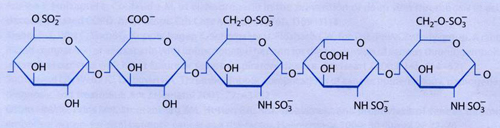
Abb. 9.3: Wirksame Pentasaccharid-Struktur der Heparine
Aktuell erleben wir eine rasante Entwicklung von neuen oralen Antikoagulantien (Dabigatran, Rivaroxaban, Apixaban), Thromobzytenaggregationshemmern (Ticagrelor, Prasugrel) und anderen Gerinnungshemmern, die die therapeutische Praxis in den nächsten Jahren dramatisch verändern wird.